Forskinga er leidd av professor Lars Herfindal. Han fullførte Dr. Scient graden i cellebiologi i 2006 ved Institutt for Biomedisin, Universitetet i Bergen. Arbeidet var om nye substansar mot akutt myelogen leukemi (AML). Har har mottatt stipend frå Helse-Vest og Den Norske Kreftforening for å nytta nanopartiklar for å betra kjemoterapi mot kreft. Herfindal har fått opplæring i produksjon av terapeutiske nanopartiklar i laboratoriet til Dr. Gillian Barratt ved Institut Galien, Universitetet i Paris (11-sud).
Forskinga har som mål å betra legemiddel-basert behandling av ulike krefttypar, med hovudfokus på leukemi (blodkreft). Dette vil me oppnå på to måtar:
- Bruka nanopartiklar til å forbetra levering av cellegift til kreftcellene, og for å unngå toksiske biverknader.
- Ta i bruk nye molekyl som kan betra behandlinga, anten ved å ha auka effekt, eller som har lågare biverknadsprofil enn eksisterande cellegifter.
Nanopartiklar i kreftbehandling.
Behandling av kreft ved bruk av cytostatika har fleire utfordringar som gjer terapien ineffektiv og i nokre tilfelle også toksiske for pasienten. Vanlegvis vil brorparten av legemiddelet verta fordelt til andre steder i kroppen enn der kreften er lokalisert, og i tillegg vil mykje av legemiddelet verta utskilt frå, eller omdanna i kroppen før det har tid til å verkja på kreftcellene. Dei fleste, om ikkje alle cellegifter har uønska biverknader på normale vev, frå harmlause tilstandar som tap av hår eller milde hudproblemer, til meir alvorlige og nokre gonger fatale tilstandar som defekt tarmfunksjon, toksisitet mot beinmarg eller hjertesvikt . Sjølv om fleire ulike cytostatika i kombinasjon har ført til mildare og meir effektive kreftbehandlingar, står lækjarar i dag framleis overfor tilfelle der bieffektane av cellegiften er meir alvorleg og invalidiserande enn sjølve sjukdommen.
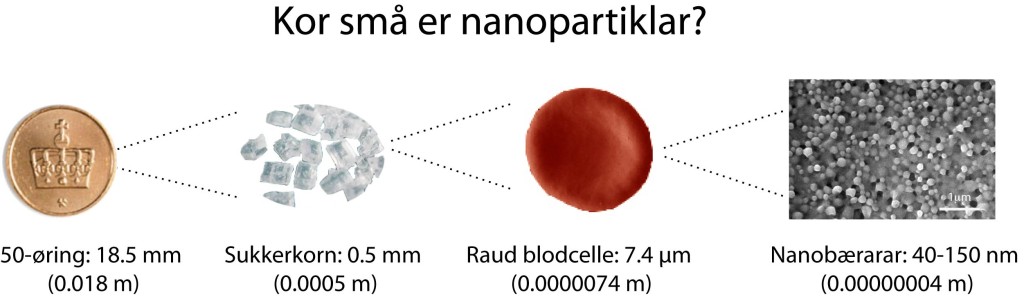
Ein måte å forbedra kjemoterapi på er å nytta små bærarar av legemiddelet. Slike bærarar har ein storleik på 20-200 nm, små nok til at dei kan sirkulera fritt i blodet. Slike vert ofte kalla nano-bærarar, eller nanopartikler.
Hvis du dekkjer ei 50-øring med eitt lag nanobærarar, treng du om lag 20 billiardar, eller 20 000 000 000 000 nanobærarar.
Vårt mål er å nytta slike nanobærarar til å forbetra behandlinga av krefttypar som ikkje kan fjernast kirurgisk, slik som ulike former for leukemi, samt solide krefttypar med spreiing (metastase).
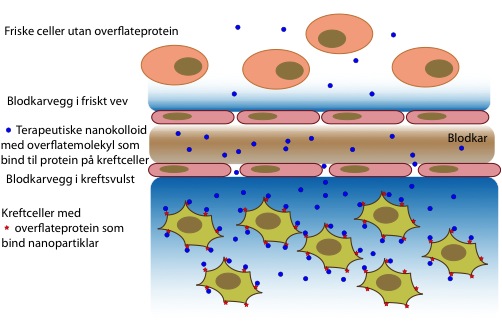
Eit av hovudproblema med kjemoterapi er at heile kroppen vert eksponert, og ikkje berre dei ondarta kreftcellene. Nanobærarar som liposom vert nytta for å unngå dette, då dei kan hindra at normalt vev vert eksponert, og vidare har dei også evna til å akkumulera i solide tumorar. Det siste er grunna den såkalte “forbedra permeabilitet og retensjon” (enhanced permeability and retention (EPR)) som er typisk for kreftsvulstar. Blodkara i svulstar har opningar som gjer at små partiklar kan passera gjennom karveggen. Vidare manglar tumorar lymfedrenasje, som fjerner overflødig væske frå vev. Eit problem med dette er at ein netto straum av væske ut av blodkara fører til eit høgt trykk i svulsten (interstitielt trykk), som kan hindra at legemiddel til å nå kreftcellene.
Me ynskjer å auka EPR-effekten slik at me får auka akkumulering av nanobærarar i svulsten. For å oppnå dette, vil me manipulera to sentrale element i dette systemet: Fyrst vil me auka opninga mellom cellene i blodkara, slik at det vil verta lettare for nanobærarar å diffundera gjennom karveggen. Deretter vil me forsøka å senka det interstitielle trykket i svulsten ved å påverka cellene som utgjer mesteparten av dette vevet. For å måla akkumulering av nanopartiklar, vil me gjera in vivo biletopptak av mus med kreft.
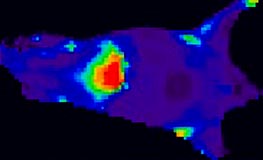
Distribusjon av fluorescente nanopartiklar i mus. Merk opphopning av nanopartiklar i lever, som er typisk for nanopartiklar som ikkje er bearbeidd for å vera usynlege for immunsystemet.
Flesteparten av cellene i en kreftsvulst ikkje er kreftceller, men normale celler som kreftcellene har rekruttert for å skapa eit gunstig miljø for vekst. Det er difor naturleg å manipulera desse normale cellene for å betra sjansane for å fjerna kreften. Me håpar me kan forbehandla kreftsvulsten slik at me får ein auka respons av kjemoterapi.
Mekanismane som fører til akkumulering av nanopartiklar i kreftsvulstar (under blodkar) i forhold til normalt vev (over blodkar).
Leukemi er ei klasse av kreft som er vanskeleg å behandla, siden den ikke kan fjernast kirurgisk. Nye fremskritt i stamcelleterapi eller transplantasjon terapi har bedra overleveling hjå mange pasientar, men alle leukemipasientar vil gjennomgå ein eller annan form for kjemoterapi. Kjemoterapi av leukemi står overfor dei samme utfordringane som ein ser med andre kreftformer.
I tillegg til uønska biverknader, er eit vanlig problem tilbakefall av leukemi, noko som vanligvis resulterer i en meir aggressiv sjukdom som er vanskelegare å behandla. For å auka effekten mot leukemiceller, vil me merke nanobærarar med molekyl som bind til protein på overflaten av cellene.
Me har allereie synt at ein kan forbetra effekten av ein liposom-basert legemiddelbærar viss ein kler denne med folat på overflata. Uttrykk av folat-bindande protein på overflata av leukemiceller gjer at liposoma fyrst og fremst vert tatt opp av desse cellene. Me vil auka selektiviteten for leukemiceller ytterlegare ved å kle liposoma med antistoff.
I tillegg har vår leiting etter naturlege forbindelsar med anti-leukemisk aktivitet gjeve nokre svært interessante resultat. Men mange av desse substansane har låg løysingsevne i vandige medium, og dårleg farmakokinetikk. Dette kan me forbetra ved å innkapsla dei i nanobærarar. Ei av forbindelsene vil me fyrst inkapsla i cyklodekstrinar, som igjen vil innkapslast i liposom, slik at me kan merka dei for målretta levering til leukemiceller.
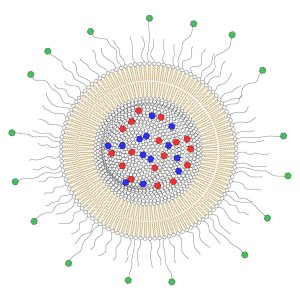
Døme på ei liposom-formulering for målretta behandling. Lumen (det indre holrommet) er fylt med ei blanding av ulike cellegifter (raudt og blått), og membranen hindrar at desse lek ut i blodbana. Overflata av liposoma er dekt med polymerar for å hindra at liposoma vert tatt opp av normale celler, og nokre av polymerkjedene har molekyl som bind til overflateprotein på leukemicellene (grønt).
Nye molekyl i kreftbehandling
Sjølv om det kjem stadig nye cellegifter, er mange av dei basert på “gamle” molekyl, og har difor lik verknadsmekanisme og effekt, og også biverknadsprofil som forgjengarane. Nye molekyl med unik verknadsmekanisme kan difor angripa kreftcellene på heilt nye måtar, og difor også nyttast i behandlinga av kreft som har utvikla resistens.
Tal frå USA syner at det kjem stadig nye småmolekylære legemiddel mot kreft.
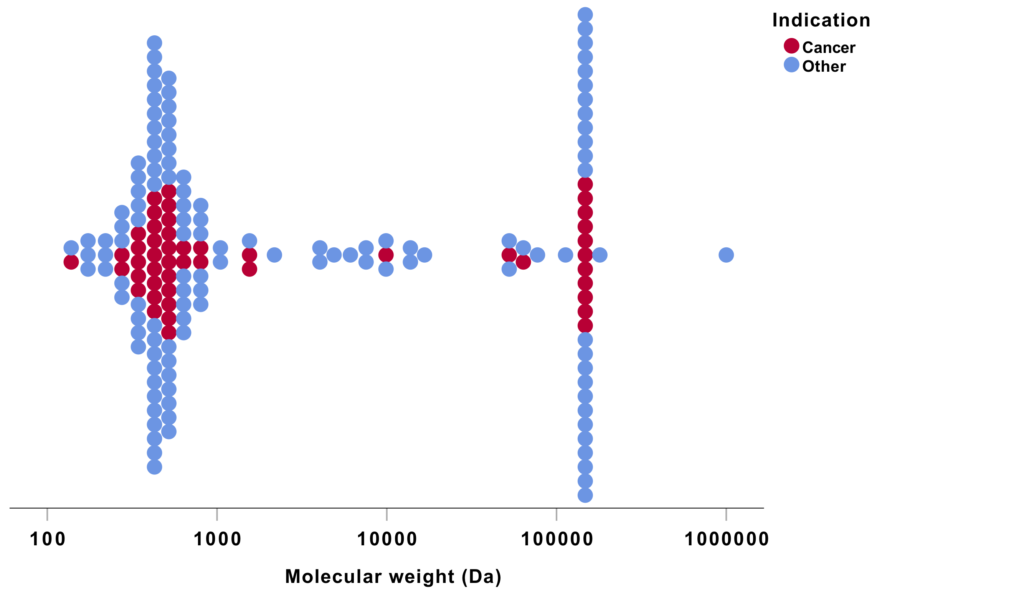
Figuren syner molekylvekta for legemiddel godkjent for bruk i USA mellom 2015 og 2018. Kvar prikk er eitt legemiddel, og raude prikkar er legemiddel mot kreft. Merk at dei fleste er små molekyl under 1000 Da. Den store gruppa rundt 150 000 Da er monoklonale antistoff.
Me har leitt etter nye molekyl frå naturen i ei årrekkje, og funne fleire lovande substansar. Vidare har me kontakt med kjemikarar som kan syntetisera nye molekyl til oss. Desse naturstoffa og molekyla testar me mot leukemiceller, normale celler, og kan finna kva for nokre som er spesielt lovande for vidare utvikling som legemiddel.